根际和叶际微生物是调控植物生长、养分吸收以及抗病抗逆的核心生态因子,传统分离培养法仅能鉴定部分可培养微生物,难以完整反映微生物群落的真实组成与分布特征。
微基生物依托荧光原位杂交(FISH)技术,提供植物根际微生物专业化 FISH 检测与冷冻切片制备服务,无需复杂培养即可实现原位定位分析,最大程度保留根际微环境中微生物的真实群落结构与分布情况。
一、FISH检测服务核心原理
荧光原位杂交(FISH)技术基于核酸分子杂交原理,针对根际样本中目标功能微生物(如固氮菌、解磷菌、植物促生菌等)的 16S rRNA 或功能基因序列,设计特异性互补荧光标记探针;探针与样本中目标微生物核酸在适宜条件下特异性结合过荧光显微镜或荧光扫描设备在细胞/组织原位观察荧光信号,实现微生物的精准定性,清晰反映根际微环境中微生物的空间分布与群落结构特征。
二、 FISH 检测服务内容
1.根际微生物 FISH 检测
针对植物根系及根际土壤微生物群落,开展样本前处理、探针杂交、荧光成像与图像分析全流程,清晰解析微生物在根系表面、根内的定殖位点及丰度特征,可检测根际促生菌(PGPM)、固氮菌、溶磷/溶钾菌等功能微生物的定殖能力与持久性。

注:图中红色荧光信号为根际细菌(EUB338通用探针标记),绿色信号为特定PGPM(定制探针标记),展示微生物在根表及根毛区的聚集分布(参考 Watt et al., 2006 小麦根FISH成像方法)。
2.多技术联合检测(定制化)
整合传统分离培养方法(选择性/富集培养基筛选)与qPCR、高通量测序等分子生物学技术,实现微生物“可培养类群鉴定+原位分布分析+群落整体多样性解析”的全方位检测,显著提升微生物检出率,全面还原植物微生态群落的结构与功能。

注:基于Romano et al., 2020提出的多方法联合评估框架优化设计,实现微生物定殖与持久性的综合分析。
三、技术优势
1.原位精准定位:无需分离培养,直接在根际微环境中定位目标微生物,真实反应器空间分布与互作关系。
2.探针高特异性:基于16S rRNA序列设计特异性探针,精准靶向特定功能微生物或微生物类群。
3.技术兼容性:可与分离培养、qPCR、高通量测序等技术联用,实现微生物群落的多维度分析。
4.样本适用范围广:适用于农作物、模式植物、林木等的根、叶等组织及相关土壤样本。
5.抗干扰能力优: 自主研发植物组织样本自发荧光淬灭试剂盒,专项解决植物根系样本高自发荧光干扰问题。
四、样本采集
1.根际土壤样本
收集紧密附着在根表 1–2mm 范围内的根际土壤,装入无菌离心管,采集量为2–5g。
2. 根表微生物样本(洗脱液 / 根段)
· 根表洗脱液:取 1–2cm 长的新鲜根段,置于含无菌 PBS 缓冲液的离心管中,充分振荡洗脱根表微生物,收集洗脱液后离心沉淀(建议沉淀量≥5mg);
· 根段样本:直接取 1–2cm 根段,立即置于 4% 多聚甲醛固定液中,4℃,避光保存。
五、服务流程
1.样本接收与前处理:接收客户提交的根际样本,去除植物组织碎片、杂质等干扰物,完成样本均质化处理。
2.样本固定:采用专用固定液处理样本,维持微生物细胞形态与核酸完整性。
3.冷冻切片/土壤涂片:对固定后的根系组织样本或土壤样本进行合适的样片制备。
4.荧光原位杂交:加入定制化荧光探针,在严格控温条件下完成核酸杂交反应。
5.荧光图像扫描:通过专业的荧光扫描设备,对杂交后的样本进行扫描成像。
6.结果分析与报告:对荧光信号进行定性定量分析,生成可视化结果与专业检测报告。
检测结果展示
植物根系纵向切片展示
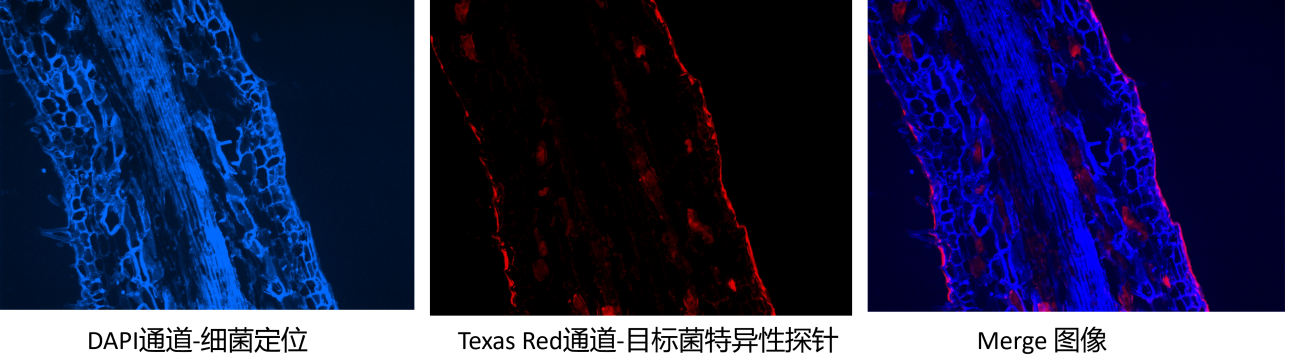
植根系纵向切片展示

蓝色荧光(DAPI染色):呈现根系样本中所有细菌的整体分布;红色荧光(FISH探针标记):定位目标功能微生物。图像叠加可直接观察目标菌在总群落中的位置与占比,快速判断目标菌的存活状态与富集情况。
欢迎科研机构、农业研发企业前来咨询合作,我们将为您提供专业的根际/叶际微生物 FISH检测解决方案,助力植物微生物组研究与绿色农业发展。
参考文献:
1. Peredo, E.L., & Simmons, S.L. (2018). Leaf-FISH: Microscale Imaging of Bacterial Taxa on Phyllosphere. Frontiers in Microbiology, 8: 2669.
2. Romano, I., Ventorino, V., & Pepe, O. (2020). Effectiveness of Plant Beneficial Microbes: Overview of the Methodological Approaches for the Assessment of Root Colonization and Persistence. Frontiers in Plant Science, 11: 6.
3.Watt, M., Hugenholtz, P., White, R., & Vinall, K. (2006). Numbers and locations of native bacteria on field-grown wheat roots quantified by fluorescence in situ hybridization (FISH). Environmental Microbiology, 8(5): 871-884.

 微基生物 您自己的微生态研究团队|专注微生态研究与应用
微基生物 您自己的微生态研究团队|专注微生态研究与应用



