1 基本概念
2 血液微生物组样本采集方法与注意事项
2.1全血取样:研究血液微生物多样性的首选
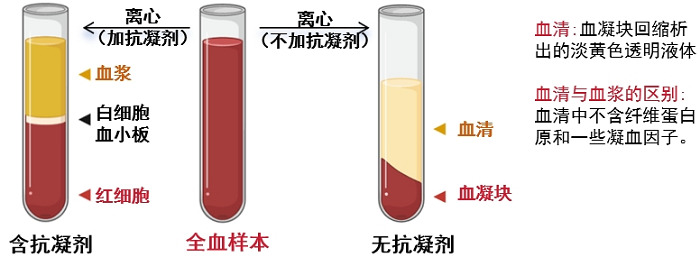
全血样本可完整保留血浆、红细胞、白细胞等各组分中的微生物及其遗传物质,是全面分析血液微生物群落的核心选择。经优化检测流程处理后,微生物检出效率与红细胞层/血细胞层样本一致性达98%以上,且无需额外离心分层,操作简单,污染风险低。
2.1.1全血样本采样步骤
采样前准备:选择符合实验条件的受试者,告知实验相关信息并签署知情同意书;准备EDTA或肝素抗凝采血管、一次性采血针、无菌注射器、冰浴设备等,确保所有耗材无菌。
采集操作:采集2-5mL外周血于抗凝采血管中或进口离心管中(提前添加抗凝剂)。轻轻颠倒摇晃混匀(不可剧烈摇晃,以防溶血)。
2.2血液中不同组分的取样:针对性研究特定微生物群落
若需聚焦特定血液组分中的微生物,可采集全血后在实验室规范离心分层,再选取目标组分检测。建议先采集全血,再进行离心处理,既满足分层样本需求,又可保留全血样本以备复检或其他检测。
血浆:微生物含量极低(仅占0.03%),聚焦细胞游离微生物DNA(cfmDNA),适用于感染早期诊断、疾病相关微生物标志物筛选等研究。
Buffy 层(白细胞层):微生物DNA含量最丰富,适用于高灵敏度微生物DNA检测,尤其适合研究胞内寄生微生物及极低丰度的微生物。
红细胞层:含少量微生物DNA,适合分析红细胞内寄生微生物,避免溶血影响核酸提取效率。
2.2.1分层样本采样步骤
采样前准备:与全血采样一致,需额外准备低温离心机、无菌离心管等设备。
全血采集:采集2-5mL外周血于抗凝采血管中或进口离心管中(提前添加抗凝剂),轻轻颠倒摇晃混匀(不可剧烈摇晃,以防溶血),4℃或冰浴静置约10min,先低温低速离心(3000rpm,10min,4℃),使血液分为血浆层(上层)、白细胞和血小板层(中层)、红细胞层(下层)。用无菌移液器或吸管分别吸取目标组分。
2.3注意事项
a)不要使用无抗凝剂的采血管(凝血后,微生物基因组提取变得非常困难)。
b)采血过程需等消毒剂(乙醇、异丙醇等)完全挥发后采样。
c)采集过程中,样品放置时间,离心时间、等保持一致。
d)红细胞/血细胞层得率约50%,1mL外周血可得约0.5mL血细胞层。
e) 样本按500μL/支分装,方便后继需要多次检测,尽量避免样本多次冻融。
f)血细胞层如发生溶血(冻存前或冻存后),只要不凝块,不影响微生物基因组DNA提取。
3 血液代谢组样本采集方法与注意事项
3.1 血浆样本代谢组检测
3.1.1 采集步骤
采集2-5mL外周血于抗凝采血管中或进口离心管中(需提前添抗凝剂),轻轻颠倒摇晃混匀(不可剧烈摇晃,以防溶血),4℃或冰浴静置约10min,先低温低速离心(3000rpm, 10min,4℃),取大部分上层血浆,200μL分装到洁净螺口管中,液氮速冻15min(可省略)。
3.1.2注意事项
a) LC-MS平台推荐使用肝素钠/EDTA 抗凝,NMR平台推荐使用肝素钠抗凝;血浆样品不推荐使用柠檬酸做抗凝剂,因为柠檬酸是TCA循环中的重要物质,使用柠檬酸钠抗凝剂会引入外源污染。而EDTA会影响NMR采谱。需注意肝素钠会对RNA相关的实验有负面作用,主要是因为会抑制反转录酶活性。请根据实验需求选择合适抗凝管。
b)采血过程需等消毒剂(乙醇、异丙醇等)完全挥发后采样。
c)采集过程中,样品放置时间,离心时间等保持一致。
d)分装使用的离心管尽可能使用低吸附离心管。
e)血浆得率约50%,1mL外周血可得约0.5mL血浆。
f) 样本按200μL/支分装,是方便后继需要多次检测,应尽量避免样本多次冻融情况。
3.2血清样本代谢组检测
3.2.1 采集步骤
采集2-5mL外周血于无任何添加剂的采血管或进口离心管中,轻轻颠倒摇晃混匀(不可剧烈摇晃,以防溶血),4℃或冰浴静置约1h(确认凝集出血块),先低温低速离心(3000rpm,10min,4℃);取大部分上层血清,将上述血清按200μL/支,分装至螺口管中,液氮速冻15min(可省略)。如血清量不够,可再次高速离心(12000rpm,10min,4℃),取剩余少量上层血清,如发生溶血,则不可再取/用。
3.2.2 注意事项
a)血清样品推荐使用无采任何添加剂的采血管(不用有促凝剂的采血管)。
b)采血过程需等消毒剂(乙醇、异丙醇等)完全挥发后采样。
c)采集过程中,样品放置时间,离心时间等保持一致。
d)血清得率约30-50%,1mL外周血可得约0.3-0.5mL血清。
e) 样本按200μL/支分装,是方便后继需要多次检测,应尽量避免样本多次冻融情况。
4 推荐采样量
|
检测类型 |
血液成分 |
推荐采集用量 |
备注 |
|
微生物组 |
全血 |
2-5mL |
添加EDTA或肝素抗凝剂 |
|
buffy层 (白细胞、血小板) |
500μL*2支 |
由2-5mL全血离心分层获得,添加抗凝剂 |
|
|
代谢组 |
血浆 |
200μL*3支 |
添加EDTA抗凝剂,离心后立即分装冷冻 |
|
血清 |
200μL*3支 |
无抗凝剂,自然凝固后离心,避免反复冻融 |
5 样本的保存和寄送
短期保存(≤24小时):采集后立即置于4℃冷藏保存,避免室温放置超过4小时。分层样本需单独密封保存,防止交叉污染,尤其血浆样本需避免与细胞组分接触导致游离DNA降解。
长期保存(>24 小时):样本按对应分装标准分装入洁净螺口管,避免反复冻融。-80℃冰箱可保存6-12个月,-20℃冰箱可短期保存1-3个月。
特殊注意事项:
需保留微生物活性或进行微生物培养的样本,必须使用抗凝剂防止凝固,存放于室温或4℃冰箱,且需尽快开展后续实验,不宜长期存放。
冷冻后的全血样本解冻后,轻微溶血可正常检测;严重溶血(血液呈酱油色)需重新采集,避免血红蛋白干扰核酸提取。
若无法实现低温保存,可使用微基生物研发的微生物DNA常温采集保存套装,样本可在常温下稳定保存14天。
6 附(抗凝管的种类和颜色)
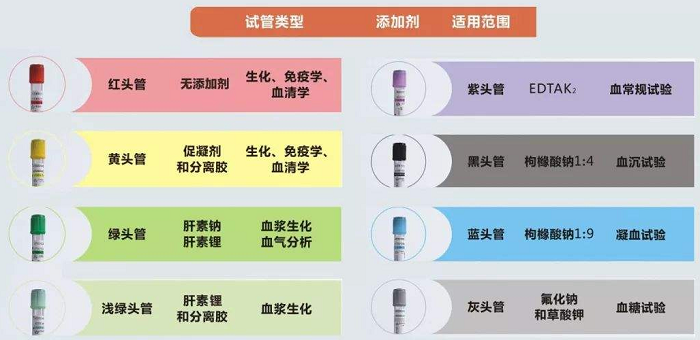
提示:血液样本的代谢组学检测,采血管只接收红盖(无添加),绿盖(添加肝素钠),紫盖(添加EDTA)。禁用PAXgene管,添加促凝剂的红盖管等。
7 常见问题解答
1)全血样本与分层样本的检测结果有差异吗?
无显著差异,全血样本经优化检测流程后,微生物检出效率与红细胞层/血细胞层样本一致性达98%以上,不影响检测准确性。
2)忘记加抗凝剂的全血样本还能检测吗?
不可检测。未抗凝的血液会发生凝固,导致细胞裂解和微生物失活,严重影响检测结果。
3)全血样本可以检测哪些微生物?
适用于检测细菌、真菌、病毒、非典型病原体等多种微生物。全血mNGS技术可以同时检测数千种微生物,提高了检测的全面性。
4)采血量对检测结果有影响吗?
有影响,采血量直接影响检测的灵敏度。推荐按标准采血量采集,采血量不足会降低微生物检出率。
5)可以使用不同类型的抗凝剂吗?
推荐使用EDTA抗凝剂;肝素抗凝剂也可使用,但需注意其可能抑制某些PCR反应;不推荐使用枸橼酸钠抗凝剂。
6)可以检测到所有病原体吗?
目前没有任何一种方法可以检测到所有病原体。不同检测方法各有优劣,微基生物可根据您的临床需求选择合适方法,必要时联合多种方法提高检出率。

 微基生物 您自己的微生态研究团队|专注微生态研究与应用
微基生物 您自己的微生态研究团队|专注微生态研究与应用